para una guía mejor y tengan mas idea
ortizcarlier
jueves, 9 de abril de 2015
martes, 13 de agosto de 2013
presentado por Edinson orlando ortiz carlier 11-3T
propiedades fisicas y quimicas de las aldehidos
Propiedades físicas
Se comportan como reductor, por oxidación el aldehído da ácidos con igual número de átomos de carbono.
La reacción típica de los aldehídos y las cetonas es la adición nucleofílica.


riesgos para la salud: aldehidos
Probablemente desde el punto de vista industrial el mas importante de los aldehídos sea elformaldehído, un gas de olor picante y medianamente tóxico, que se usa en grandes cantidadespara la producción de plásticos termoestables como la bakelita.La solución acuosa de formaldehído se conoce como f ormolo formalina y se usa ampliametecomo desinfectante, en la industria textil y como preservador de tejidos a la descomposición
http://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
Propiedades Físicas
riesgos para la salud: cetonas
La mayor parte de los aldehídos y cetales pueden causar irritación de la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado en los miembros inferiores de una serie, en los miembros con la cadena alifática insaturada y en los miem- bros con sustitución halógena. Los aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de algunos de ellos posiblemente obligen al trabajador a limitar la exposición antes de que ésta sea suficiente como para que se manifiesten los efectos anestésicos. El efecto irritante en las mucosas puede estar relacionado con el efecto cilioestático que inhibe el movimiento de los cilios que tapizan el tracto respiratorio con funciones esencialmente de limpieza. El grado de toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos, pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros miembros de la familia son cancerígenos conocidos o sospechosos y exigen la adopción de medidas de precaución siempre que exista posibilidad de contacto con ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la capacidad de producir un efecto hipnótico. En el texto siguiente y en las tablas adjuntas se facilitan más datos sobre miembros específicos de la familia.
Las cetonas se encuentran ampliamente distribuidas en la naturaleza. El importante carbohidrato fructuosa, las hormonas cortisona, testosterona (hormona masculina) y progesterona (hormona femenina) son también cetonas, así como el conocido alcanfor usado como medicamento tópico.
La acetona y metil-etil-cetona se usan extensamente en la industria como disolventes.
En la vida doméstica la acetona es el disolvente por excelencia para las pinturas de uñas y una mezcla de

.jpg)
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-la-cetona/
http://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
http://www.buenastareas.com/ensayos/Usos-Aldehidos-Cetonas-Alcoholes-Fenoles-Esteres/817374.html
propiedades fisicas y quimicas de las aldehidos
Propiedades físicas
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomérica. Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio la reacción tiene que ser débil , las cetonas también se obtienen de la dehidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
Propiedades químicas
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomérica. Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio la reacción tiene que ser débil , las cetonas también se obtienen de la dehidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
Propiedades químicas
Se comportan como reductor, por oxidación el aldehído da ácidos con igual número de átomos de carbono.
La reacción típica de los aldehídos y las cetonas es la adición nucleofílica.


riesgos para la salud: aldehidos
La mayor parte de los aldehídos y cetales pueden causar irritación de la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado en los miembros inferiores de una serie, en los miembros con la cadena alifática insaturada y en los miem- bros con sustitución halógena. Los aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de algunos de ellos posiblemente obligen al trabajador a limitar la exposición antes de que ésta sea suficiente como para que se manifiesten los efectos anestésicos. El efecto irritante en las mucosas puede estar relacionado con el efecto cilioestático que inhibe el movimiento de los cilios que tapizan el tracto respiratorio con funciones esencialmente de limpieza. El grado de toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos, pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros miembros de la familia son cancerígenos conocidos o sospechosos y exigen la adopción de medidas de precaución siempre que exista posibilidad de contacto con ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la capacidad de producir un efecto hipnótico. En el texto siguiente y en las tablas adjuntas se facilitan más datos sobre miembros específicos de la familia.
uso de los aldehidos
Los usos principales de los aldehidos son:
la fabricación de resinas, plásticos,solventes, tinturas, perfumes y esencias.
Los dos efectos más importantes de los aldehidos son:
narcotizantes eirritantes.
El glutaraldehido se usa como
desinfectante en frío (Instrunet®) y el curtido depieles. Es causante de dermatitis alérgicas
El formaldehido se usa en:
a) Fabricación de plásticos y resinas.b) Industria fotográfica, explosivos y colorantesc) Como antiséptico y preservador
Los usos principales de los aldehídos son
*La fabricación deresinas
*Plásticos
*Solventes
Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa,es un polihidroxialdehído La vanillina saborizante principal de la vainilla es otro ejemplo dealdehído natural
uso de los aldehidos
Los usos principales de los aldehidos son:
la fabricación de resinas, plásticos,solventes, tinturas, perfumes y esencias.
Los dos efectos más importantes de los aldehidos son:
narcotizantes eirritantes.
El glutaraldehido se usa como
desinfectante en frío (Instrunet®) y el curtido depieles. Es causante de dermatitis alérgicas
El formaldehido se usa en:
a) Fabricación de plásticos y resinas.b) Industria fotográfica, explosivos y colorantesc) Como antiséptico y preservador
Los usos principales de los aldehídos son
*La fabricación deresinas
*Plásticos
*Solventes
*pinturas
*Perfumes
*Esencias
Los aldehídos están presentes en numerosos productos naturales y grandes variedades deellos son de la propia vida cotidiana. Laglucosapor ejemplo existe en una forma abiertaque presenta un grupo aldehído.
Elacetaldehídoformado como intermedio en lametabolización se cree responsable en gran medida de los síntomas de la resaca tras laingesta de bebidas alcohólicas
El formaldehídoes un conservante que se encuentra en algunas composiciones de productos cosméticos
Los aldehídos están presentes en numerosos productos naturales y grandes variedades deellos son de la propia vida cotidiana. Laglucosapor ejemplo existe en una forma abiertaque presenta un grupo aldehído.
Elacetaldehídoformado como intermedio en lametabolización se cree responsable en gran medida de los síntomas de la resaca tras laingesta de bebidas alcohólicas
El formaldehídoes un conservante que se encuentra en algunas composiciones de productos cosméticos
Sin embargo esta aplicación debe ser vista con cautela ya que enexperimentos con animales el compuesto ha demostrado un poder cancerígeno. También seutiliza en la fabricación de numerosos compuestos químicos como la baquelita, la melamina etc
Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa,es un polihidroxialdehído La vanillina saborizante principal de la vainilla es otro ejemplo dealdehído natural
bibliografia
http://es.scribd.com/doc/29517247/Usos-de-Los-Aldehidoshttp://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
propiedades fisicas y quimicas de las cetonas
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular.No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
Propiedades Químicas
Las cetonas se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.
riesgos para la salud: cetonas
La mayor parte de los aldehídos y cetales pueden causar irritación de la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado en los miembros inferiores de una serie, en los miembros con la cadena alifática insaturada y en los miem- bros con sustitución halógena. Los aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de algunos de ellos posiblemente obligen al trabajador a limitar la exposición antes de que ésta sea suficiente como para que se manifiesten los efectos anestésicos. El efecto irritante en las mucosas puede estar relacionado con el efecto cilioestático que inhibe el movimiento de los cilios que tapizan el tracto respiratorio con funciones esencialmente de limpieza. El grado de toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos, pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros miembros de la familia son cancerígenos conocidos o sospechosos y exigen la adopción de medidas de precaución siempre que exista posibilidad de contacto con ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la capacidad de producir un efecto hipnótico. En el texto siguiente y en las tablas adjuntas se facilitan más datos sobre miembros específicos de la familia.
Usos de las cetonas
Las cetonas se encuentran ampliamente distribuidas en la naturaleza. El importante carbohidrato fructuosa, las hormonas cortisona, testosterona (hormona masculina) y progesterona (hormona femenina) son también cetonas, así como el conocido alcanfor usado como medicamento tópico.
La acetona y metil-etil-cetona se usan extensamente en la industria como disolventes.
En la vida doméstica la acetona es el disolvente por excelencia para las pinturas de uñas y una mezcla de
ambas se usa como disolvente-cemento de los tubos de PVC

.jpg)
bibliografia
http://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
http://www.buenastareas.com/ensayos/Usos-Aldehidos-Cetonas-Alcoholes-Fenoles-Esteres/817374.html
.
martes, 23 de julio de 2013
los alcoholes
En química se denomina alcohol (del árabe al-kuḥl الكحول, o al-ghawl الغول, "el espíritu", "toda sustancia pulverizada", "líquido destilado") a aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos,1 esto diferencia a los alcoholes de los fenoles.
Si contienen varios grupos hidroxilos se denominan polialcoholes. Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.

Nomenclatura
*Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos alcohol metílico, alcohol etílico, alcohol propílico, etc
*IUPAC: añadiendo una l (ele) al sufijo -ano en el nombre del hidrocarburo precursor (met-ano-l, de donde met- indica un átomo de carbono, -ano- indica que es un hidrocarburo alcano y -l que se trata de un alcohol), e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo (3-butanol, por ejemplo).
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a uncarbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Halogenación de alcoholes
Para clorar o bromar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Los alcoholes terciarios reaccionan con ácido clorhídrico directamente para producir el cloroalcano terciario, pero si se usa un alcohol primario o secundario es necesaria la presencia de un ácido de Lewis, un "activador", como el cloruro de zinc. Como alternativa la conversión puede ser llevada a cabo directamente usando cloruro de tionilo (SOCl2). Un alcohol puede también ser convertido a bromoalcano usando ácido bromhídrico o tribromuro de fósforo (PBr3), o a yodoalcano usando fósforo rojo y yodo para generar "in situ" el triyoduro de fósforo. Dos ejemplos:
(H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Véase también: Halogenuros de alquilo.
Oxidación de alcoholes
Metanol: Existen diversos métodos para oxidar metanol a formaldehído y/o ácido fórmico, como la reacción de Adkins-Peterson.
Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído Cr03/H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 10 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza un enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar..
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.

SOLUBILIDAD EN EL AGUA: .Gracias al grupo -OHcaracterístico de los alcoholes, se pueden presentar puentes dehidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendosignificancia y a partir del hexanol la sustancia se torna aceitosa.
PUNTO DE EBULLICION: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrogeno, son mas dificiles de romper.
PUNTO DE FUSION: Presenta el mismo comportamiento que el punto de ebullicion, aumenta a medida que aumenta el numero de carbonos.
DENSIDAD: Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moleculas
PRIMARIO:
Se designan con el nombre de hidrocarburos correspondientes terminado en OL; o bien con la palabra alcohol seguida del hidrocarburo correspondiente y la terminación ICO.
EJEMPLO:
a.-CH3 OH
Metanol o alcohol metalico
b.-CH3 – CH2 – CH2 – CH2 – CH2OH
Butanol-1 o alcohol butílico-1 o alcohol butílico.
SECUNDARIOS:
Se nombran terciarios de un modo semejante al anterior pero indicando después de la terminación OL, el numero de átomo de carbono de la cadena en que está fijada la función del alcohol. Ejemplo:
CH3 – CH2 – CHOH-CH3
Butanol-2
Según la naturaleza del átomo de carbono en el que se en lasa el oxhidrilo OH, los alcoholes se clasifican en primarios, secundarios y terciarios.
Metanol: también conocido bajo el nombre de alcohol metílico o de quemar presenta la siguiente fórmula química: CH3OH y se caracteriza por presentar una estructura química próxima a la del agua. En estado natural, este alcohol es incoloro, líquido y con sabor y olor frutal. Además, es inflamable y sumamente tóxico. Si se lo mezcla con aire, puede originar combustibles con elevado poder calorífico. Es a partir de este compuesto que se obtienen el metano y el formol.
Su obtención proviene de la síntesis de hidrógeno y monóxido de carbono por medio de procesos catalíticos. Para realizar estos procedimientos se utilizan elevadas presiones y temperaturas.
Etanol: también conocido bajo el nombre de alcohol etílico o simplemente alcohol, se caracteriza por ser líquido, incoloro y con gusto a quemado. Su fórmula química es H3C-CH2-OH y es el alcohol utilizado para la producción de bebidas alcohólicas tales como el vino, la sidra y el brandy, entre otras. Para la obtención del etanol, sin presencia de agua, se recurre a procesos de destilación azeotrópicas en ciclohexano o benceno. Además de ser utilizado en la producción de bebidas alcohólicas, el etanol es requerido en el ámbito de la industria química, farmacéutica e industrial. También, es usado para combustibles domésticos e incluso industriales.
Hay que tener en cuenta que su consumo afecta a la coordinación de los miembros del cuerpo, a la visión y también puede ocasionar somnolencia, mareos y euforia.
Butanol: también conocido bajo el nombre de alcohol butílico, este compuesto orgánico se caracteriza por encontrarse en estado líquido, ser incoloro, poseer un aroma particular. Además, es muy inflamable y soluble en agua. Su fórmula química es H3C-(CH2)3-OH y se lo utiliza para síntesis orgánicas de ésteres disolventes, en coloraciones, también es usado como disolvente, como agente deshidratante y para la producción de detergente, entre otras cosas. El butanol es obtenido a partir de trietil aluminio y del óxido de etileno.
En caso de ser inhalado, puede ocasionar anestesia, tos, sueño, dificultades en la respiración y aturdimiento. Si llega a entrar en contacto con la piel o con los ojos ocasiona irritación.
Octanol: éste se encuentra naturalmente en aceites esenciales en forma de ésteres. Se lo usa principalmente para la producción de ésteres que son requeridos para generar sabores y en el área de perfumería, también es utilizado en el ámbito de la medicina para la realización de experimentos. Su fórmula química es CH3(CH2)7OH
Alcohol etílico
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Usos y aplicaciones del alcohol etílico
Su fórmula química es principalmente utilizada en las bebidas alcohólicas como en el vino, la cerveza o en licores.
Alcohol isopropílico
Es también llamado 2-propanol o propan-2-ol, es un alcohol incoloro, inflamable, con un olor intenso y muy miscible con el agua. Su fórmula química semidesarrollada es H3C-HCOH-CH3 y es el ejemplo más sencillo de alcohol secundario, donde el carbono del grupo alcohol está unido a otros dos carbonos. Es un isómero del propanol.
Usos y aplicaciones del alcohol isopropílico
El alcohol isopropílico es muy utilizado en la limpieza de lentes de objetivos fotográficos y contactos de aparatos electrónicos, ya que no deja marcas y es de rápida evaporación.
Alcohol metílicoEl compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero, de baja densidad, incoloro, inflamable y tóxico..

Los efectos del alcohol sobre el cuerpo son numerosos y diversos. El alcohol, específicamente el etanol, es una potente droga psicoactiva con un número elevado de efectos terciarios que puede afectar de manera grave a nuestro organismo. La cantidad y las circunstancias del consumo juegan un rol importante al determinar la duración de la intoxicación. Por ejemplo, al consumir alcohol después de una gran comida es menos probable que se produzcan signos visibles de intoxicación que con el estómago vacío.1 La hidratación también juega un rol importante, especialmente al determinar la duración de las resacas.
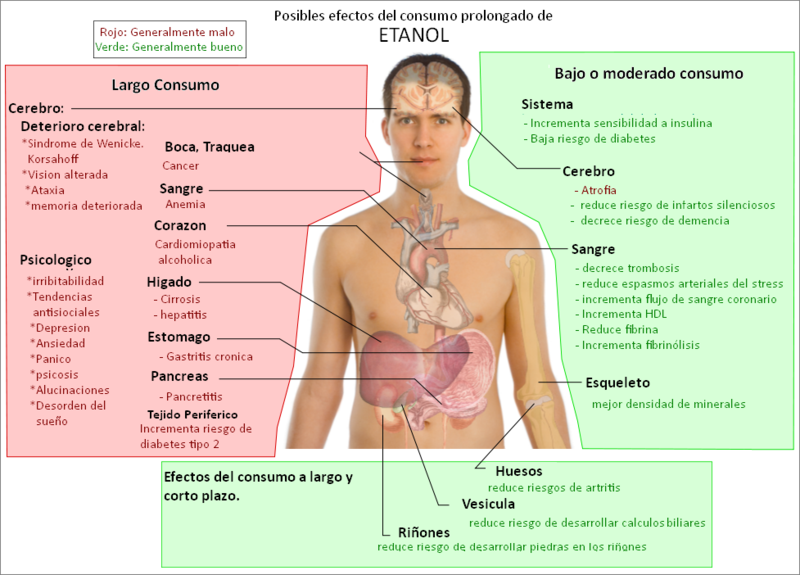
riesgos de los alcoholes en el cuerpo humano
Previene enfermedades del corazón: Se dice que los antioxidantes en el vino tinto ayudan a la salud del corazón y el sistema cardiovascular. Las personas activas, que consumen por lo menos una bebida alcohólica a la semana, tienen un 50% menos de probabilidades de desarrollar una enfermedad cardíaca que una persona que se pasa todo el día frente al televisor.
Aumenta el colesterol 'bueno': La cerveza y el vino pueden aumentar el nivel de lipoproteínas de alta densidad (HDL, en inglés) que son capaces de retirar el colesterol de las arterias y transportarlo de vuelta al hígado para su excreción, lo que ayuda a evitar enfermedades como la arteriosclerosis. Sin embargo, hay que tener cuidado con las calorías de la cerveza, especialmente las de las oscuras; el abdomen podría sufrir las consecuencias.
Reduce la artritis: El alcohol puede disminuir considerablemente las posibilidades de contraer artritis en la vejez. Sin embargo, su consumo excesivo pude aumentar el riesgo de desarrollar la osteoporosis. Así, mientras una copa de vino puede evitar el dolor persistente de los huesos, también puede volverlos más propensos a romperse como ramitas. La solución: un 'ruso blanco', un cóctel de vodka con leche, que podría ayudar a los huesos de las dos maneras.
Aumenta la fibra: Al derivar de granos, la cerveza es realmente una fuente de buena fibra dietética, buena para aliviar algunos problemas de estreñimiento, hemorroides, diverticulosis y síndrome de intestino (colon) irritable. De hecho, medio litro (unas dos tazas) de cerveza puede proporcionar más de un cuarto de su ingesta diaria necesaria de fibra. Pero tenga cuidado, demasiada fibra puede conducir a visitar el inodoro más veces de lo debido.
Previene ciertos tipos de cáncer: Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas: Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
Acetato de 2 Etil Hexilo: olor a dulzón suave
butanoato de metilo: olor a Piña
salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
octanoato de heptilo: olor a frambuesa
etanoato de isopentilo: olor a plátano
pentanoato de pentilo: olor a manzana
butanoato de pentilo: olor a pera o a albaricoque
etanoato de octilo: olor a naranja.
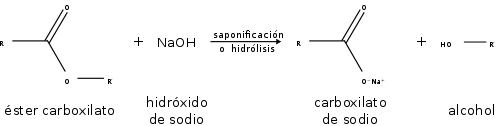
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
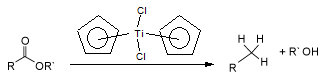
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 reflujado con THF.3
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
ácido acetil salicílico fue introducida en la clínica en 1899 siendo utilizada como analgésico, anti-inflamatorio, antipirético y antitrombótico. Una vez en el organismo, el ácido acetilsalicíco es hidrolizado a salicilato, que también es activo. Las propiedades analgésicas y anti-inflamatorias del ácido acetil-salicílico son parecidas a las de otros anti-inflamatorios no esteroídicos. El ácido acetilsalicílico es utilizado en el tratamiento de numerosas condiciones inflamatorias y auto inmunes como la artritis juvenil, la artritis reumatoidea, y la osteoartritis. Por sus propiedades antitrombóticas se utiliza para prevenir o reducir el riesgo de infarto de miocardio y de ataques transitorios de isquemia. Durante la mayor parte del siglo XX, la aspirina fué utilizada como analgésico y anti-inflamatorio, pero a partir de 1980 se puso de manifiesto su capacidad para inhibir la agregación plaquetaria, siendo utilizada cada vez más para esta indicación. Más recientemente se ha demostrado que el tratamiento crónico con ácido acetilsalicílico (más de 10 años) reduce el riesgo de cáncer de colon. Se sabe hoy día que la aspirina posee propiedades antiproliferativas.

salicilato de metilo que está indicado para el alivio sintomático de alteraciones músculo esqueléticas, de articulaciones y tejidos blandos como dolores reumáticos, contusiones, esguinces, contracturas, tendinitis, etc., para lo cual se usa en concentraciones del 10-25%. También forma parte de formulaciones destinadas a inhalaciones, para el alivio sintomático de alteraciones del tracto respiratorio superior. Se usa en preparados en forma de cremas y pomadas en concentraciones del 10 al 25%. Se debe conservar protegido de la luz.

salicilato de fenilo es un antiséptico estomacal de uso muy amplio. Los ácidos no lo hidrolizan y, por lo tanto, pasa a través del estómago sin cambios. En el medio alcalino intestinal, ocurre la hidrólisis a fenol y salicilato. También se emplea como capa entérica para algunas píldoras medicinales a fin de permitir su paso a través del estómago intactas y desintegrarse en el intestino.

Los fluorocarburos se derivan de los hidrocarburos mediante
sustitución por flúor de todos o algunos de sus átomos de hidró-
geno. Los hidrocarburos en los que se ha reemplazado alguno de
los átomos de hidrógeno por cloro o bromo, además de los que
fueron por flúor (es decir, clorofluorhidrocarburos, bromofluorhidrocarburos) suelen incluirse en la clasificación de fluorocarburos; por ejemplo, el bromoclorodifluorometano (CClBrF2).
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
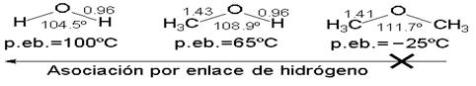
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Cuclo propano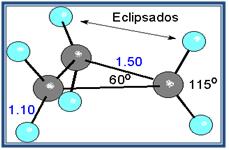
Epóxido de etileno
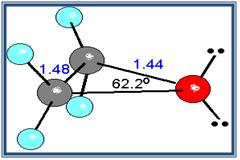
Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
PROPIEDADES QUÍMICAS:
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
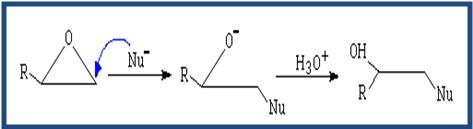
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
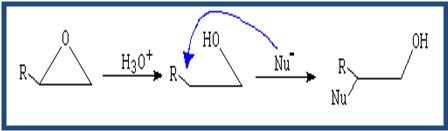
(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.
En química se denomina alcohol (del árabe al-kuḥl الكحول, o al-ghawl الغول, "el espíritu", "toda sustancia pulverizada", "líquido destilado") a aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos,1 esto diferencia a los alcoholes de los fenoles.
Si contienen varios grupos hidroxilos se denominan polialcoholes. Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
Nomenclatura
*Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos alcohol metílico, alcohol etílico, alcohol propílico, etc
*IUPAC: añadiendo una l (ele) al sufijo -ano en el nombre del hidrocarburo precursor (met-ano-l, de donde met- indica un átomo de carbono, -ano- indica que es un hidrocarburo alcano y -l que se trata de un alcohol), e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo (3-butanol, por ejemplo).
Propiedades químicas de los alcoholes
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a uncarbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Halogenación de alcoholes
Para clorar o bromar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Los alcoholes terciarios reaccionan con ácido clorhídrico directamente para producir el cloroalcano terciario, pero si se usa un alcohol primario o secundario es necesaria la presencia de un ácido de Lewis, un "activador", como el cloruro de zinc. Como alternativa la conversión puede ser llevada a cabo directamente usando cloruro de tionilo (SOCl2). Un alcohol puede también ser convertido a bromoalcano usando ácido bromhídrico o tribromuro de fósforo (PBr3), o a yodoalcano usando fósforo rojo y yodo para generar "in situ" el triyoduro de fósforo. Dos ejemplos:
(H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Véase también: Halogenuros de alquilo.
Oxidación de alcoholes
Metanol: Existen diversos métodos para oxidar metanol a formaldehído y/o ácido fórmico, como la reacción de Adkins-Peterson.
Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído Cr03/H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 10 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza un enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar..
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
propiedades fisicas

SOLUBILIDAD EN EL AGUA: .Gracias al grupo -OHcaracterístico de los alcoholes, se pueden presentar puentes dehidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendosignificancia y a partir del hexanol la sustancia se torna aceitosa.
PUNTO DE EBULLICION: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrogeno, son mas dificiles de romper.
PUNTO DE FUSION: Presenta el mismo comportamiento que el punto de ebullicion, aumenta a medida que aumenta el numero de carbonos.
DENSIDAD: Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moleculas
tipos de alcoholes
PRIMARIO:
Se designan con el nombre de hidrocarburos correspondientes terminado en OL; o bien con la palabra alcohol seguida del hidrocarburo correspondiente y la terminación ICO.
EJEMPLO:
a.-CH3 OH
Metanol o alcohol metalico
b.-CH3 – CH2 – CH2 – CH2 – CH2OH
Butanol-1 o alcohol butílico-1 o alcohol butílico.
SECUNDARIOS:
Se nombran terciarios de un modo semejante al anterior pero indicando después de la terminación OL, el numero de átomo de carbono de la cadena en que está fijada la función del alcohol. Ejemplo:
CH3 – CH2 – CHOH-CH3
Butanol-2
Según la naturaleza del átomo de carbono en el que se en lasa el oxhidrilo OH, los alcoholes se clasifican en primarios, secundarios y terciarios.
Metanol: también conocido bajo el nombre de alcohol metílico o de quemar presenta la siguiente fórmula química: CH3OH y se caracteriza por presentar una estructura química próxima a la del agua. En estado natural, este alcohol es incoloro, líquido y con sabor y olor frutal. Además, es inflamable y sumamente tóxico. Si se lo mezcla con aire, puede originar combustibles con elevado poder calorífico. Es a partir de este compuesto que se obtienen el metano y el formol.
Su obtención proviene de la síntesis de hidrógeno y monóxido de carbono por medio de procesos catalíticos. Para realizar estos procedimientos se utilizan elevadas presiones y temperaturas.
Etanol: también conocido bajo el nombre de alcohol etílico o simplemente alcohol, se caracteriza por ser líquido, incoloro y con gusto a quemado. Su fórmula química es H3C-CH2-OH y es el alcohol utilizado para la producción de bebidas alcohólicas tales como el vino, la sidra y el brandy, entre otras. Para la obtención del etanol, sin presencia de agua, se recurre a procesos de destilación azeotrópicas en ciclohexano o benceno. Además de ser utilizado en la producción de bebidas alcohólicas, el etanol es requerido en el ámbito de la industria química, farmacéutica e industrial. También, es usado para combustibles domésticos e incluso industriales.
Hay que tener en cuenta que su consumo afecta a la coordinación de los miembros del cuerpo, a la visión y también puede ocasionar somnolencia, mareos y euforia.
Butanol: también conocido bajo el nombre de alcohol butílico, este compuesto orgánico se caracteriza por encontrarse en estado líquido, ser incoloro, poseer un aroma particular. Además, es muy inflamable y soluble en agua. Su fórmula química es H3C-(CH2)3-OH y se lo utiliza para síntesis orgánicas de ésteres disolventes, en coloraciones, también es usado como disolvente, como agente deshidratante y para la producción de detergente, entre otras cosas. El butanol es obtenido a partir de trietil aluminio y del óxido de etileno.
En caso de ser inhalado, puede ocasionar anestesia, tos, sueño, dificultades en la respiración y aturdimiento. Si llega a entrar en contacto con la piel o con los ojos ocasiona irritación.
Octanol: éste se encuentra naturalmente en aceites esenciales en forma de ésteres. Se lo usa principalmente para la producción de ésteres que son requeridos para generar sabores y en el área de perfumería, también es utilizado en el ámbito de la medicina para la realización de experimentos. Su fórmula química es CH3(CH2)7OH
Alcohol etílico
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Usos y aplicaciones del alcohol etílico
Su fórmula química es principalmente utilizada en las bebidas alcohólicas como en el vino, la cerveza o en licores.
Alcohol isopropílico
Es también llamado 2-propanol o propan-2-ol, es un alcohol incoloro, inflamable, con un olor intenso y muy miscible con el agua. Su fórmula química semidesarrollada es H3C-HCOH-CH3 y es el ejemplo más sencillo de alcohol secundario, donde el carbono del grupo alcohol está unido a otros dos carbonos. Es un isómero del propanol.
Usos y aplicaciones del alcohol isopropílico
El alcohol isopropílico es muy utilizado en la limpieza de lentes de objetivos fotográficos y contactos de aparatos electrónicos, ya que no deja marcas y es de rápida evaporación.
Alcohol metílicoEl compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero, de baja densidad, incoloro, inflamable y tóxico..
Efectos del alcohol en el cuerpo
Los efectos del alcohol sobre el cuerpo son numerosos y diversos. El alcohol, específicamente el etanol, es una potente droga psicoactiva con un número elevado de efectos terciarios que puede afectar de manera grave a nuestro organismo. La cantidad y las circunstancias del consumo juegan un rol importante al determinar la duración de la intoxicación. Por ejemplo, al consumir alcohol después de una gran comida es menos probable que se produzcan signos visibles de intoxicación que con el estómago vacío.1 La hidratación también juega un rol importante, especialmente al determinar la duración de las resacas.

riesgos de los alcoholes en el cuerpo humano
Previene enfermedades del corazón: Se dice que los antioxidantes en el vino tinto ayudan a la salud del corazón y el sistema cardiovascular. Las personas activas, que consumen por lo menos una bebida alcohólica a la semana, tienen un 50% menos de probabilidades de desarrollar una enfermedad cardíaca que una persona que se pasa todo el día frente al televisor.
Aumenta el colesterol 'bueno': La cerveza y el vino pueden aumentar el nivel de lipoproteínas de alta densidad (HDL, en inglés) que son capaces de retirar el colesterol de las arterias y transportarlo de vuelta al hígado para su excreción, lo que ayuda a evitar enfermedades como la arteriosclerosis. Sin embargo, hay que tener cuidado con las calorías de la cerveza, especialmente las de las oscuras; el abdomen podría sufrir las consecuencias.
Reduce la artritis: El alcohol puede disminuir considerablemente las posibilidades de contraer artritis en la vejez. Sin embargo, su consumo excesivo pude aumentar el riesgo de desarrollar la osteoporosis. Así, mientras una copa de vino puede evitar el dolor persistente de los huesos, también puede volverlos más propensos a romperse como ramitas. La solución: un 'ruso blanco', un cóctel de vodka con leche, que podría ayudar a los huesos de las dos maneras.
Aumenta la fibra: Al derivar de granos, la cerveza es realmente una fuente de buena fibra dietética, buena para aliviar algunos problemas de estreñimiento, hemorroides, diverticulosis y síndrome de intestino (colon) irritable. De hecho, medio litro (unas dos tazas) de cerveza puede proporcionar más de un cuarto de su ingesta diaria necesaria de fibra. Pero tenga cuidado, demasiada fibra puede conducir a visitar el inodoro más veces de lo debido.
Previene ciertos tipos de cáncer: Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas: Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
esteres
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  | 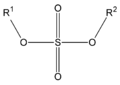 |
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
Acetato de 2 Etil Hexilo: olor a dulzón suave
butanoato de metilo: olor a Piña
salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
octanoato de heptilo: olor a frambuesa
etanoato de isopentilo: olor a plátano
pentanoato de pentilo: olor a manzana
butanoato de pentilo: olor a pera o a albaricoque
etanoato de octilo: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 reflujado con THF.3
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
usos de los esteres en la industria
ácido acetil salicílico fue introducida en la clínica en 1899 siendo utilizada como analgésico, anti-inflamatorio, antipirético y antitrombótico. Una vez en el organismo, el ácido acetilsalicíco es hidrolizado a salicilato, que también es activo. Las propiedades analgésicas y anti-inflamatorias del ácido acetil-salicílico son parecidas a las de otros anti-inflamatorios no esteroídicos. El ácido acetilsalicílico es utilizado en el tratamiento de numerosas condiciones inflamatorias y auto inmunes como la artritis juvenil, la artritis reumatoidea, y la osteoartritis. Por sus propiedades antitrombóticas se utiliza para prevenir o reducir el riesgo de infarto de miocardio y de ataques transitorios de isquemia. Durante la mayor parte del siglo XX, la aspirina fué utilizada como analgésico y anti-inflamatorio, pero a partir de 1980 se puso de manifiesto su capacidad para inhibir la agregación plaquetaria, siendo utilizada cada vez más para esta indicación. Más recientemente se ha demostrado que el tratamiento crónico con ácido acetilsalicílico (más de 10 años) reduce el riesgo de cáncer de colon. Se sabe hoy día que la aspirina posee propiedades antiproliferativas.
salicilato de metilo que está indicado para el alivio sintomático de alteraciones músculo esqueléticas, de articulaciones y tejidos blandos como dolores reumáticos, contusiones, esguinces, contracturas, tendinitis, etc., para lo cual se usa en concentraciones del 10-25%. También forma parte de formulaciones destinadas a inhalaciones, para el alivio sintomático de alteraciones del tracto respiratorio superior. Se usa en preparados en forma de cremas y pomadas en concentraciones del 10 al 25%. Se debe conservar protegido de la luz.

salicilato de fenilo es un antiséptico estomacal de uso muy amplio. Los ácidos no lo hidrolizan y, por lo tanto, pasa a través del estómago sin cambios. En el medio alcalino intestinal, ocurre la hidrólisis a fenol y salicilato. También se emplea como capa entérica para algunas píldoras medicinales a fin de permitir su paso a través del estómago intactas y desintegrarse en el intestino.

riesgos de los esteres para el cuerpo humano
FLUOROCARBUROSLos fluorocarburos se derivan de los hidrocarburos mediante
sustitución por flúor de todos o algunos de sus átomos de hidró-
geno. Los hidrocarburos en los que se ha reemplazado alguno de
los átomos de hidrógeno por cloro o bromo, además de los que
fueron por flúor (es decir, clorofluorhidrocarburos, bromofluorhidrocarburos) suelen incluirse en la clasificación de fluorocarburos; por ejemplo, el bromoclorodifluorometano (CClBrF2).
eteres
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.

La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Cuclo propano

Epóxido de etileno

Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
PROPIEDADES QUÍMICAS:
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.

(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.

( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido
.
bibliografia
- PROPIEDADES FISICAS DE LOS ALCOHOLES | LOS ALCOHOLESde alcoholwww.tiposde.org
lunes, 15 de julio de 2013
Suscribirse a:
Comentarios (Atom)
.jpg)
.jpg)